国产11价HPV疫苗获准临床试验,可进一步提高预防范围
来源: 澎湃新闻
2019-02-22 20:00
发表于山东
近日,由国药中生生物技术研究院有限公司、北京生物制品研究所有限责任公司和成都生物制品研究所有限责任公司联合申报的11价重组人乳头瘤病毒(HPV)疫苗获得国家药监局颁发的临床试验批件。
这标志着该疫苗已经正式进入国内上市注册流程,相应开展的临床试验数据也将作为注册上市的评审依据。
据中国生物官网介绍,较2价、4价和9价HPV疫苗,此次获批临床试验的11价重组HPV疫苗针对中国HPV病毒流行特征增加了相应的高危HPV型别,可进一步提高对宫颈癌等疾病的预防范围。这也是目前获批临床试验中价次最多的HPV疫苗。
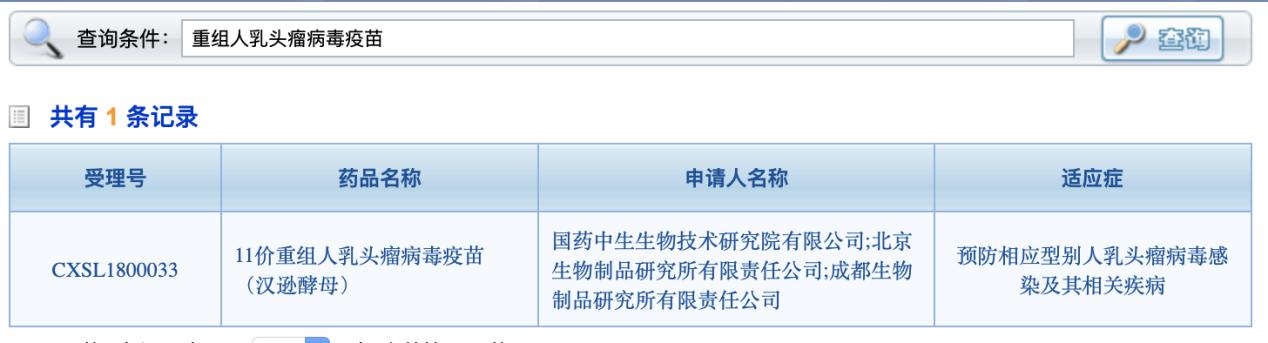
澎湃新闻(www.thepaper.cn)查询国家药监局药品审评中心,临床试验默许栏目中,该试验已被收录。
目前,在国内上市的HPV疫苗,包括葛兰素史克(GSK)2价、默沙东4价和9价HPV疫苗,均为进口疫苗。
国内企业研发的HPV疫苗均处于或即将进入临床试验阶段,尚未投入市场。其中,由厦门万泰沧海生物技术有限公司申报的二价宫颈癌疫苗进展较快,丁香园Insight数据库查询显示,该疫苗曾于2018年7月完成审评。截至2019年1月28日,厦门万泰沧海的二价HPV疫苗已完成了药学、药理毒理、临床的全部审评,将有望很快获批上市。
此外,澎湃新闻查询发现,11价HPV疫苗获得的是临床试验默认许可。
2018年7月27日,国家药监局发布《关于调整药物临床试验审评审批程序的公告》(以下简称《公告》),我国药物临床试验审评审批制度正式由审批制变为到期默认制。
《公告》明确,“在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心(以下简称药审中心)否定或质疑意见的,可按照提交的方案开展药物临床试验”。
国家药品监督管理局药品审评中心首席科学家何如意在2018年6月接受采访时称,此前临床试验受理时长平均为10个月。药物临床试验审评制度的改革,可简化审评审批程序。
这标志着该疫苗已经正式进入国内上市注册流程,相应开展的临床试验数据也将作为注册上市的评审依据。
据中国生物官网介绍,较2价、4价和9价HPV疫苗,此次获批临床试验的11价重组HPV疫苗针对中国HPV病毒流行特征增加了相应的高危HPV型别,可进一步提高对宫颈癌等疾病的预防范围。这也是目前获批临床试验中价次最多的HPV疫苗。
澎湃新闻(www.thepaper.cn)查询国家药监局药品审评中心,临床试验默许栏目中,该试验已被收录。
目前,在国内上市的HPV疫苗,包括葛兰素史克(GSK)2价、默沙东4价和9价HPV疫苗,均为进口疫苗。
国内企业研发的HPV疫苗均处于或即将进入临床试验阶段,尚未投入市场。其中,由厦门万泰沧海生物技术有限公司申报的二价宫颈癌疫苗进展较快,丁香园Insight数据库查询显示,该疫苗曾于2018年7月完成审评。截至2019年1月28日,厦门万泰沧海的二价HPV疫苗已完成了药学、药理毒理、临床的全部审评,将有望很快获批上市。
此外,澎湃新闻查询发现,11价HPV疫苗获得的是临床试验默认许可。
2018年7月27日,国家药监局发布《关于调整药物临床试验审评审批程序的公告》(以下简称《公告》),我国药物临床试验审评审批制度正式由审批制变为到期默认制。
《公告》明确,“在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心(以下简称药审中心)否定或质疑意见的,可按照提交的方案开展药物临床试验”。
国家药品监督管理局药品审评中心首席科学家何如意在2018年6月接受采访时称,此前临床试验受理时长平均为10个月。药物临床试验审评制度的改革,可简化审评审批程序。
来源: 澎湃新闻
阅读量:17.5W
236

打开“闪电新闻”看评论